聚腺苷二磷酸核糖聚合酶(PARP)抑制剂最初有望使特定人群受益:那些携带 BRCA(乳腺癌相关)基因突变且随后患上乳腺癌或卵巢癌的人。但自其问世以来,我们发现它们能惠及更广泛的卵巢癌女性群体,同时也在其他癌症患者中进行了探索。
首先解释为何 PARP 抑制剂被提议用于治疗携带遗传性 BRCA 突变人群的乳腺癌或卵巢癌,然后再更广泛地探讨其在卵巢癌及其他癌症中的应用。
要理解 PARP 抑制剂,需要先了解几个概念:
什么是 PARP?
PARP 抑制剂的作用机制是什么?
什么是 BRCA 基因和 BRCA 蛋白?
为什么携带遗传性 BRCA 突变的人患癌风险极高?
为什么 PARP 抑制剂可能对携带遗传性 BRCA 基因突变的人的癌症有效?
对于没有遗传性 BRCA 突变的卵巢癌患者,PARP 抑制剂的效果如何?
为什么 PARP 抑制剂可能对胰腺癌和前列腺癌有效?
1 什么是 PARP?
PARP蛋白在细胞DNA单链断裂的修复中起着至关重要的作用(见图1 )。在我们身体数十亿个细胞中,这种DNA的微小损伤每天都在发生。DNA损伤通常由氧自由基引起——氧自由基是细胞产生能量时产生的高能氧原子。氧自由基的产生是不可避免的,它们常常是导致DNA出现这些微小缺口的原因。
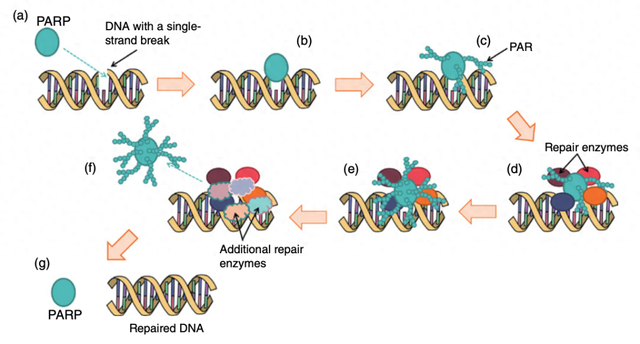
图1 PARP 酶的功能。(a) PARP 检测到染色体中的单链断裂,并且 (b) 附着在受损的DNA上。(c) PARP 利用 NAD + 生成名为 PAR 的聚合物长链,它将这些长链附着在自身上从而变得有活性。(d) 有活性的 PARP 将其他蛋白质募集到受损的 DNA处;这些蛋白质启动修复过程。(e) 更多的PAR 被添加到 PARP 上,其对 DNA的亲和力降低。(f) PARP 离开修复位点,使其他修复蛋白能够进入并完成修复过程。(g) DNA 修复过程完成,PAR 从 PARP 表面去除。
幸运的是,借助 PARP 和其他蛋白质,我们的细胞具备修复 DNA 单链断裂的良好能力。
2 PARP 抑制剂的作用机制是什么?
PARP 蛋白(至少有 18 个家族成员)并非激酶,因此不能用激酶抑制剂来阻断它们。相反,PARP 抑制剂是一类小分子化合物,其作用主要体现在两个方面(见图2):
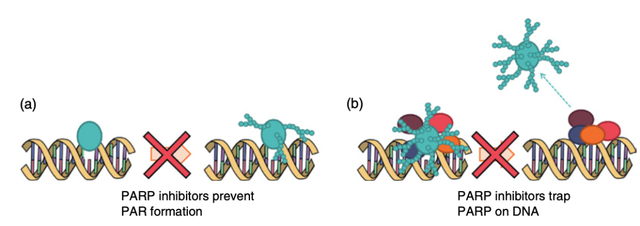
图2 聚(ADP-核糖)聚合酶(PARP)抑制剂的作用机制。(a) PARP 抑制剂阻止聚(ADP-核糖)(PAR)的形成,并且 (b) 导致 PARP 酶被困在 DNA 上。
与一种名为 NAD⁺的化学物质竞争 PARP 蛋白上的结合位点。PARP 需要 NAD⁺来生成聚腺苷二磷酸核糖(PAR)并招募其他修复蛋白。若无法获得 NAD⁺,PARP 的功能就会受阻,受损的 DNA 也就无法得到修复。
当 PARP 附着到受损 DNA 上后,PARP 抑制剂会阻止其脱离。科学家将这种现象称为 “PARP 捕获”,这对细胞具有高度毒性。PARP 会被有效地卡在 DNA 双螺旋上,若细胞在 PARP 仍未脱离的情况下试图增殖,就无法完成分裂,进而导致细胞 DNA 完全断裂。
许多科学家认为,PARP 抑制剂会导致细胞 DNA 双链断裂(即染色体断裂成两段)的积累。不过,并非所有科学家都认同这一点。但他们一致认为,PARP 抑制剂会引发一些问题,健康细胞能够克服这些问题,而 BRCA 基因存在缺陷的细胞则会因此死亡。
3. 什么是 BRCA 基因和 BRCA 蛋白?
BRCA蛋白(BRCA1 和 BRCA2)只是参与同源重组(HR)过程的一系列蛋白质中的两种。同源重组是细胞用于修复DNA双链断裂的一种非常精确且高效的过程。BRCA1 和 BRCA2 对于同源重组都至关重要,但它们在该过程中发挥的作用截然不同。如果一个细胞缺失其中任何一种BRCA蛋白,就无法进行同源重组。
顾名思义,细胞中用于合成BRCA1和BRCA2蛋白的两个基因分别被称为 BRCA1和 BRCA2。
20 世纪 90 年代中期,科学家在研究乳腺癌和卵巢癌为何有时会在家族中遗传时发现了这两种BRCA基因。我们每个人的每个基因都有两个拷贝,分别来自父母双方。科学家发现,如果一个人继承了BRCA1或 BRCA2其中一个拷贝的缺陷,那么其患乳腺癌和 / 或卵巢癌的风险会远高于常人:
携带 BRCA1 或 BRCA2 缺陷基因的女性中,约 70% 会在 80 岁前患上乳腺癌。
携带 BRCA1 缺陷基因的女性中,近 45% 会在 80 岁前患上卵巢癌;携带 BRCA2 缺陷基因的女性中,这一比例约为 20%。
继承了 BRCA1 或 BRCA2 突变的人,患胰腺癌、胃癌、喉癌和前列腺癌的风险也会更高。
4 为什么携带遗传性 BRCA 突变的人患癌风险极高?
如果一个人继承了某个 BRCA 基因的缺陷,那么这种缺陷会存在于其身体的每一个细胞中。但由于我们每个基因都有两个拷贝,一个拷贝的缺陷并不一定会造成灾难性后果。事实上,即使我们的细胞中只有一个功能正常的 BRCA1 或 BRCA2 拷贝,也能正常发育。一个广为人知的例子是演员兼导演安吉丽娜・朱莉,她公开表示自己继承了有缺陷的 BRCA1 基因,其母亲、祖母和姑姑都因癌症去世。
尽管携带 BRCA1或 BRCA2基因突变的人出生时是健康的,但他们患癌症的风险比大多数人高得多。问题在于,我们细胞的DNA每天都会受到损伤,这种损伤会影响整个基因组。对于携带遗传性BRCA1 或BRCA2突变的人来说,细胞随时都有可能发生第二次突变,这次突变会影响到受影响的 BRCA 基因的健康拷贝。如果这种情况发生在乳腺或卵巢(或输卵管)细胞中,结果可能是毁灭性的(见图3)。原本正常运作的细胞会失去 BRCA1 或 BRCA2 的健康拷贝。BRCA1 和 BRCA2 蛋白在物理性质上差异很大,无法相互替代。因此,如果细胞完全缺失其中任何一种 BRCA 蛋白,就无法进行同源重组。在这种情况下,细胞只能依靠其他方法来修复 DNA 双链断裂,而这些方法的准确性要低得多。

图3 从 BRCA 基因突变到癌症的路径。(a)如果一个人出生时其 BRCA 基因中的一个存在缺陷(一颗红星),那么他们身体中的每个细胞都将携带该缺陷。但是每个细胞中该基因的第二个健康副本足以维持他们的健康(橙色细胞)。(b)如果受影响的 BRCA 基因的第二个副本在乳腺或卵巢 / 输卵管细胞中受损(两颗红星),这个细胞将完全无法进行同源重组(深红色细胞)。相反,该细胞将不得不依赖一种容易出错的方法(称为非同源末端连接 - NHEJ)来修复其 DNA 的双链断裂。(c)由于依赖 NHEJ,该细胞逐渐积累越来越多的 DNA 损伤 —— 它在基因组上不稳定。它对许多重要基因造成损伤积累并变成癌细胞;它迅速增殖,肿瘤就形成了。
细胞修复 DNA 双链断裂的主要备用方法是非同源末端连接(NHEJ)。在非同源末端连接过程中,细胞基本上是将 DNA 的两个末端强行连接在一起。依赖非同源末端连接的细胞容易出现大量错误,并且会迅速积累 DNA 突变。事实上,缺失其中一种BRCA蛋白而不得不依赖非同源末端连接的细胞,其基因组是不稳定的。这些细胞的染色体最终会出现大量严重错误,并有可能变成癌细胞。表1总结了携带遗传性 BRCA 基因缺陷的人所患癌症的其他一些特征。
表1
肿瘤
特征
带有遗传性BRCA1基因突变的乳腺癌人群
在患有遗传性BRCA1 基因突变的生理女性中,确诊的乳腺癌大多(69%)为“三阴性”;然而,三阴性乳腺癌在生理男性中极为罕见。
三阴性乳腺癌细胞既不含雌激素或孕激素受体,其表面也没有HER2。这类乳腺癌很可能具有侵袭性,且难以治疗。
带有遗传性BRCA2基因突变的乳腺癌人群
这些癌症的特征因人而异,但无论是在生理女性还是男性中,它们通常都含有雌激素和孕激素受体。只有约16% 的病例为三阴性。
携带遗传性BRCA1 或BRCA2 基因突变人群的卵巢癌
这些往往是高级别(即极具侵袭性)的浆液性卵巢癌。这种癌症有时起始于卵巢,但也可能起源于输卵管。这些癌症至少在开始时往往对化疗非常敏感。但它们在基因组上也不稳定,很快就会对治疗产生耐药性。
关于 BRCA 突变与癌症,有一个让科学家困惑的问题:为什么 BRCA 基因突变尤其容易引发乳腺癌和卵巢癌,而不是其他类型的癌症?尽管许多科学家对此进行了研究,但尚未达成共识,只是普遍认为 BRCA 基因、性激素(如雌激素)与 DNA 损伤之间可能存在联系。
5 用于携带遗传性 BRCA 基因突变且患有乳腺癌或卵巢癌患者的 PARP 抑制剂
到目前为止,我们已经了解到BRCA和PARP蛋白都参与DNA修复。PARP 酶对修复 DNA单链断裂很重要,BRCA蛋白参与同源重组这一修复双链断裂的无错方法。但你可能会问:这与PARP抑制剂有什么关系呢?
事实证明,当健康细胞接触PARP抑制剂(如奥拉帕利、卢卡帕利、尼拉帕利或他拉唑帕利)时,能够存活下来。但是,如果细胞完全缺失其中一种 BRCA 蛋白,接触PARP抑制剂就足以使其死亡。对于携带遗传性 BRCA 基因突变的人来说,只有他们的癌细胞完全缺失其中一种 BRCA 蛋白,因此理论上只有这些细胞会死亡(见图4)。
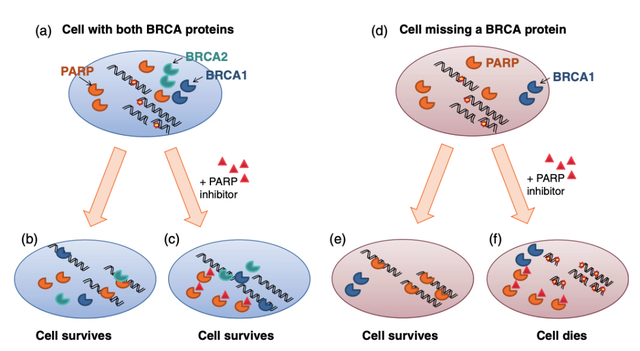
图4 聚(ADP - 核糖)聚合酶(PARP)抑制剂能够杀死缺乏 BRCA 蛋白之一的细胞。(a)蓝色椭圆代表健康细胞的细胞核,在其中可以找到PARP和两种 BRCA蛋白(以及DNA修复所需的所有其他蛋白)。该细胞的DNA不断受到损伤(以黄色带刺圆圈和断裂的黑色DNA链表示)。(b)单链断裂通过依赖 PARP的过程进行修复;双链断裂则利用同源重组(HR)进行修复,而 HR 依赖于BRCA蛋白。(c)将细胞暴露于PARP抑制剂(红色三角形)下,会阻止其修复单链断裂,这些单链断裂最终会变成双链断裂。然而,双链断裂可通过 HR 进行修复,细胞得以存活。(d)酒红色椭圆代表患有遗传性BRCA基因突变(在这种情况下影响 BRCA2)的人的癌细胞的细胞核。该细胞含有 PARP,但完全缺失BRCA2蛋白。由于只剩下BRCA1,该细胞无法进行 HR。这导致细胞基因组不稳定,最终使其变成癌细胞。(e)当癌细胞的 DNA 受损时,它会使用PARP(修复单链断裂)或非同源末端连接(NHEJ,修复双链断裂)来修复损伤,这足以维持细胞存活。(f)如果患者接受 PARP 抑制剂治疗,这将阻止其所有细胞使用 PARP 修复单链断裂。这些断裂最终会变成双链断裂,而患者的癌细胞只能使用如NHEJ 这种容易出错的方法来修复。细胞会迅速积累达到临界水平的 DNA 损伤,然后死亡。而患者体内其他仍保留受影响 BRCA 基因健康拷贝的细胞,能够进行足够的 HR 以维持存活(未显示)。
科学家常将 PARP 抑制剂用于与缺陷型 BRCA 基因相关的癌症治疗称为 “合成致死” 的一个例子。这指的是癌细胞无法进行同源重组,再加上接触 PARP 抑制剂,这两种情况结合(即 “合成”)会导致癌细胞死亡。
在以下癌症患者中,可发现 BRCA1 或 BRCA2 的遗传性致病性(即致病的)突变:
2%-5% 的乳腺癌患者(三阴性乳腺癌患者中比例高达 20%)
10%-15% 的卵巢癌患者
这些是已知携带 BRCA 基因致病性变异的人群比例。令人颇为困惑的是,在 BRCA 基因中已发现的变异数量极多。在人类群体中,已发现 BRCA1 和 BRCA2 有超过 3000 种不同的变异,而我们并非了解所有这些变异的意义。对于其中一些变异,情况很明确,这种遗传性变异显然会使携带者患癌风险很高。但对于其他变异,很难判断它们是危险的突变还是无害的变异。这些变异通常被称为意义未明的变异(VUS)。
6 用于未继承 BRCA 基因突变的卵巢癌患者的 PARP 抑制剂
希望我已经阐明了为何 PARP抑制剂对缺失某种 BRCA 蛋白、进而无法进行同源重组(HR)的乳腺癌和卵巢癌有效。这也是早期一些PARP抑制剂试验仅纳入携带遗传性 BRCA 基因突变患者的原因。
然而,关键之处并不在于癌细胞缺失 BRCA 蛋白,而在于它们无法进行同源重组。事实上,尽管约 10%-15% 的卵巢癌发生在携带遗传性 BRCA 基因突变的人群中,但在约 50% 的卵巢癌病例中,癌细胞都无法进行同源重组(图5)。这要么是由于影响同源重组相关基因的遗传性(种系)突变,要么是由于个体一生中发生的(体细胞)突变所致。
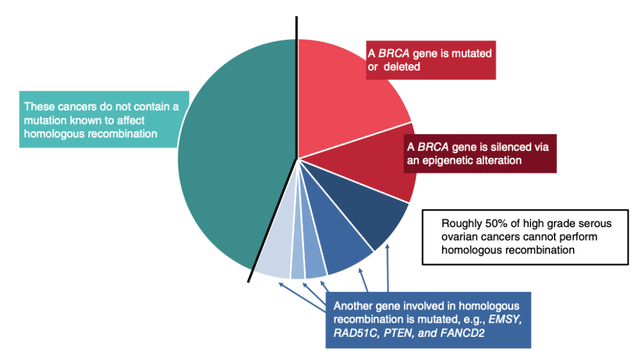
图5 大约一半的高级别浆液性卵巢癌无法进行同源重组。这是由于 BRCA 基因缺陷或 BRCA 基因受到抑制,或者是由于参与该过程的另一个基因发生突变。
多项大型试验同时纳入了同源重组缺陷(HRD)和同源重组正常(HR-proficient)的卵巢癌患者。这些试验结果清楚地表明,同源重组缺陷型癌症患者从 PARP 抑制剂中获益最大(其中一项试验的结果示例见图6)。
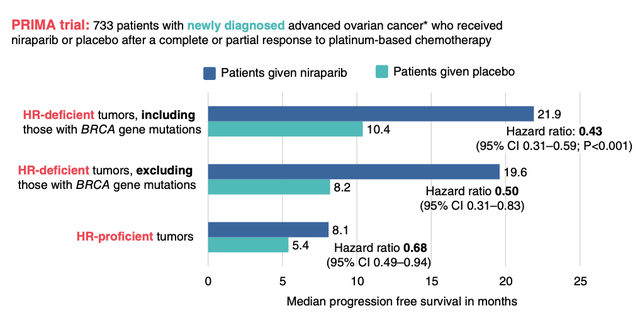
图6 与同源重组修复(HR)功能正常的癌症患者相比,HR 缺陷型癌症患者从聚腺苷二磷酸核糖聚合酶(PARP)抑制剂中获益更多。PRIMA 试验的数据表明,无论 HR 缺陷是由 BRCA 基因突变还是 HR 过程中的其他缺陷引起,情况都是如此。HR 功能正常的癌症患者使用 PARP 抑制剂(尼拉帕利)仍能获得一定益处,但获益程度不如 HR 缺陷型癌症患者,无进展生存期更长就证明了这一点。
对铂类化疗的敏感性与PARP抑制剂之间也存在关联。这类化疗药物(如顺铂和卡铂)通过造成 DNA断裂发挥作用。无法进行同源重组的细胞难以修复这种损伤。因此,同源重组缺陷是对铂类化疗和 PARP 抑制剂均敏感的一个原因。正因为如此,如果患者的癌症对铂类化疗敏感,这意味着它可能也对 PARP 抑制剂敏感。
7 作为其他癌症治疗手段的 PARP 抑制剂
到目前为止,我已经讨论了将 PARP 抑制剂用于携带遗传性 BRCA 基因缺陷的乳腺癌或卵巢癌患者,以及更广泛的卵巢癌同源重组缺陷患者群体。
但 PARP 抑制剂的应用范围还更广:
已获批用于治疗携带遗传性 BRCA 突变的胰腺癌患者(这部分患者约占胰腺癌确诊病例的 4%-7%)。
若前列腺癌患者存在 BRCA 基因或其他参与同源重组的基因的种系(遗传性突变)或体细胞(仅存在于癌细胞中的非遗传性突变)突变,PARP 抑制剂也已获批用于该类患者的治疗。在转移性前列腺癌病例中,约 20% 存在这些突变。
对于因其他原因(如存在 ATM、ATR、PALB2 或 FANC 基因家族突变,这些基因均参与同源重组)而携带 BRCA 突变或存在同源重组缺陷的其他癌症患者,PARP 抑制剂可能也有帮助。
目前,PARP 抑制剂还在对铂类化疗敏感的癌症,或与免疫检查点抑制剂联合使用的临床试验中。
截至目前,已有四种 PARP 抑制剂在美国或欧洲 / 英国获批用于癌症治疗(见表2)。
表2 截至 2024 年 3 月已获批的 PARP 抑制剂概述

8 PARP 抑制剂疗效的生物标志物
正如我前面所概述的,在多种情况下,一个人可能会患上(可能)对 PARP 抑制剂治疗敏感的癌症:
携带遗传性 BRCA 基因突变(种系突变)。
一生中发生的突变(体细胞突变)导致其患上的癌症缺失某种 BRCA 蛋白。
种系或体细胞突变(非 BRCA 基因突变)导致所患癌症的细胞存在同源重组缺陷。
但问题是,如何最好地检测这些不同情况,从而预测谁会从 PARP 抑制剂治疗中受益,谁不会。
有几种潜在的检测方法:
利用血液或唾液样本中的健康细胞检测种系 BRCA 突变。
利用活检或其他肿瘤样本中的癌细胞检测体细胞 BRCA 突变。
检测一系列参与同源重组的基因(如 ATM、ATR、PALB2 和 FANC 基因)的各种突变。
评估癌细胞进行同源重组的能力。
寻找表明同源重组存在缺陷的 DNA 损伤模式。
观察癌症对铂类化疗的敏感性。
检测导致对 PARP 抑制剂耐药的突变。
用于筛选适合接受 PARP 抑制剂治疗的患者的最常见方法是检测各种种系或体细胞突变、寻找 DNA 损伤模式或利用铂类药物敏感性。
9 PARP 抑制剂的耐药机制
对于一些在卵巢癌手术后接受 PARP 抑制剂辅助治疗的患者,PARP 抑制剂成功地阻止了癌症复发。然而,与几乎所有癌症治疗方法一样,一些患者的癌症对 PARP 抑制剂天生耐药(固有耐药),另一些患者的癌症起初对治疗有反应,随后又开始生长(获得性耐药)。
PARP 抑制剂的耐药原因可分为两类:涉及恢复细胞同源重组能力的耐药机制和不涉及恢复同源重组的耐药机制。
涉及恢复同源重组的耐药机制示例:
有时,额外的突变可以恢复细胞产生其最初失去合成能力的蛋白质(如 BRCA 蛋白)的能力。
有时,同源重组基因发生更细微的表观遗传变化,可以恢复缺失蛋白的产生。
不涉及恢复同源重组的耐药机制示例:
在一些患者中,癌细胞通过切换到其他修复机制,降低了对缺失或功能异常的同源重组蛋白的依赖。
细胞可能会增加 PARP 蛋白的产量,或者产生无法被 PARP 抑制剂阻断的突变型 PARP 蛋白。
有时,癌细胞会将药物排出,其排出速度与药物进入速度相当,从而避免受到药物的影响。
10 克服 PARP 抑制剂的耐药性
克服PARP抑制剂耐药性的最常见策略似乎是采用某种联合用药方案,例如:
PARP 抑制剂与化疗或放疗联合使用。
PARP 抑制剂与靶向治疗(如 WEE1 抑制剂、PI3K 抑制剂或血管生成抑制剂)联合使用。
PARP 抑制剂与免疫检查点抑制剂联合使用。
PARP 抑制剂与激素治疗(用于前列腺癌患者)联合使用。
然而,到目前为止,这些联合用药策略都尚未成为获批的治疗方案。
